HPA轴异常对HPO轴的影响
2023-05-09 13:15:03 点击数:(一)HPA轴功能亢进对HPO轴的影响
库欣综合征(Cushing syndromes)又称皮质醇增多症,是一组因HPA轴调控失常,肾上腺皮质分泌过多糖皮质激素而导致的以向心性肥胖、满月脸、多血质外貌、紫纹、高血压、继发性糖尿病和骨质疏松等症状为表现的临床综合征,包括垂体或者垂体外分泌ACTH的肿瘤,肾上腺皮质肿瘤或者结节以及外源性糖皮质激素过多。以垂体分泌ACTH过多所致的库欣病最为常见。可在任何年龄发病,但多发于20~45岁,成人多于儿童,女性多于男性。
Cushing综合征主要是由于皮质醇长期分泌过多引起的蛋白质、脂肪、糖、电解质代谢紊乱,并可干扰多种其他激素的分泌。Cushing综合征的临床表现有多种类型。①典型病例:表现为向心性肥胖、满月脸、多血质、痤疮、紫纹、血压增高、月经失调、性功能障碍等。多为垂体性库欣病、肾上腺腺瘤、异位ACTH综合征中的缓进型。②重型:主要特征为体重减轻、摄食减少、高血压、重度低血钾性碱中毒、水肿、肌无力,多为迅速进展的异位ACTH综合征、肾上腺癌肿。③早期病例:以肥胖为主,向心性不够显著,血压稍高,一般情况较好,尿游离皮质醇稍增高,低剂量地塞米松试验可有一定程度的抑制。④年龄较大以并发症为主就诊者,如心力衰竭、脑卒中、病理性骨折、精神症状或肺部感染,Cushing综合征易被忽略。⑤成年男性出现女性化或女性明显男性化应怀疑肾上腺癌。
Cushing综合征的治疗原则是去除引起肾上腺皮质醇增多的病因,一般而言肿瘤以手术治疗为主,对于没有生育要求者,手术切除范围是垂体前叶次全切除。手术的治愈率为70%~80%,复发率约为10%。当手术存在禁忌或失败时,可行药物治疗,包括:肾上腺酶抑制剂(酮康唑、甲吡酮、依托咪酯)、糖皮质激素受体拮抗剂(米非司酮)及生长抑素类似物(奥曲肽)、卡麦角林。除死于围术期及并发症外,Cushing综合征常是可以治愈的。高皮质醇血症的相关症状和体征在治疗后2~12个月可以逐渐消退。
Cushing综合征的女性患者,肾上腺分泌过多的皮质醇及雄激素,皮质醇对垂体促性腺激素产生抑制作用;罕见异位升高的CRH及ACTH也影响下丘脑垂体分泌GnRH及LH;肾上腺来源的雄激素过多以及肥胖均引起性腺外的雄激素过多转化为雌激素,从而对下丘脑垂体的反馈作用发生紊乱,最终引起血清雌激素的降低及无排卵状态。大多数患者出现月经减少、月经不规律或停经,并常见痤疮。
Cushing综合征的患者有75%伴有排卵异常,故未治疗者常伴有不孕症。Cushing综合征患者的始基卵泡数目显著下降,卵巢皮质基质增生缺乏、黄素化缺陷,卵巢纤维化、体积减少。妊娠女性以ACTH依赖性Cushing综合征居多,其原因可能为单纯肾上腺增生分泌过多的皮质醇相对于ACTH增多同时引起皮质醇及雄激素分泌过多对于排卵的干扰要小。
对于孕前已发生的Cushing综合征,少数病例,妊娠会加重病情。少数病例,Cushing综合征在产后可获得恢复。但也有报道,在多次妊娠后,疾病复发者。可能的机制包括胎盘CRH、异位表达在肾上腺皮质的促黄体激素受体/绒毛膜促性腺激素受体以及雌激素依赖的结节性肾上腺增生。
妊娠期,胎盘部位的11β-羟类固醇脱氢酶可以将85%的母体皮质醇转化为无活性的皮质酮,从而保护胎儿。但是,Cushing综合征未治疗者的自然流产率、早产率、围产儿死亡率是升高的,并且可能发生新生儿肾上腺功能不全。在孕期,母亲约70%发生高血压、25%发生妊娠期糖尿病、子痫前期,少数者发生心衰,甚至发生孕妇死亡。
妊娠期疾病诊断方法同非孕期,但目前没有一致的指标。妊娠期的治疗仍首推对无其他并发症的孕妇在孕中期行手术治疗,不愿意行手术治疗者,可选择甲吡酮口服。酮康唑虽有致畸影响,但在妊娠期可用以治疗Cushing综合征。但2011年中国库欣综合征专家共识指出,妊娠期间禁用酮康唑、甲吡酮及米托坦;而首选手术治疗。
(二)HPA轴功能减退对HPO轴的影响
1.先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)
CAH是最为常见的一组常染色体隐性遗传性疾病,发生率约为1/20 000~1/16 000,其主要病理机制在于肾上腺皮质类固醇激素生物合成过程中某种代谢酶的先天性完全或部分缺乏,引起肾上腺皮质合成皮质醇及皮质酮不足,经下丘脑-垂体-肾上腺轴反馈调节,使促肾上腺皮质激素释放激素及促肾上腺皮质激素分泌增加,导致肾上腺皮质增生、肾上腺皮质激素合成过程中的中间产物堆积及人体代谢紊乱。95%以上的CAH为21-羟化酶缺乏症(21 hydroxylase deficiency,21-OHD),是 CYP21A2 基因突变所致。其他引起CAH的代谢酶的缺陷类型包括:11β-羟化酶缺陷症(11β-OHD),3β-羟类固醇脱氢酶(3βhydroxysteroid dehydrogenase,3β-HSD)缺陷症,17α-羟化酶缺陷症(17α-OHD)、17β-羟类固醇脱氢酶(17β-HSD)以及类固醇激素急性调节蛋白(steroid acute regulatory protein,StAR)缺陷症。图6-2显示肾上腺皮质激素的合成过程中各代谢酶的作用环节。
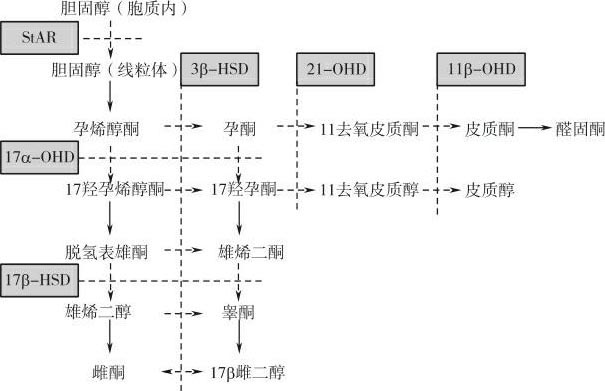
图6-2 肾上腺皮质激素合成过程中各代谢酶缺陷的作用环节
StAR:类固醇激素急性调节蛋白作用环节
21-0HD:21羟化酶缺陷作用环节
11B-0HD:11β羟化酶缺陷作用环节
3β-HSD:3β羟类固醇脱氢酶缺陷作用环节
17α-0HD:17α羟化酶缺陷作用环节
17β-HSD:17β羟类固醇脱氢酶缺陷作用环节
21-OHD所致CAH主要改变为皮质醇合成减少及雄激素合成增加,造成肾上腺雄激素前体物质(孕酮,17-羟孕酮,脱氢表雄酮)及其代谢产物(如21-脱氧皮质醇)分泌增加。根据酶缺乏程度及临床表现的不同,21-OHD可分为失盐型(salt wasting form)、单纯男性化型(simple virilizing form)、非经典型(non-classical form)三大类。失盐型是由于21-羟化酶活性完全缺乏所致,为最严重型,常于新生儿期发病,表现为呕吐、腹泻、脱水、严重的代谢性酸中毒、低血钠、顽固性高钾血症与低血糖。单纯男性化型则为21-OHD活性部分缺乏,血醛固酮和皮质醇合成部分受阻,醛固酮在反馈性ACTH调节下合成正常而无失盐症状,主要的临床表现为雄激素水平升高症状与体征。非经典型中酶轻度缺乏,患儿出生后多无临床症状,但随着年龄增加而出现雄激素水平升高体征;女性患者可表现为月经初潮延迟、月经过少、原发性闭经、多毛症及不孕症。
CAH的治疗主要是提供足够的皮质醇,以减少CRH、ACTH及雄激素的分泌。双亲同时携带有经典的 CYP21A2 突变者,可以在妊娠早期补充地塞米松,但其长期影响尚缺乏资料。同时应用盐皮质激素可降低皮质醇的应用剂量。对于因治疗及雄激素过度引起的性早熟患儿使用生长激素、GnRH类似物、芳香化酶抑制剂及抗雄激素制剂等可改善其最终身高。对于有外生殖器异常的女性患者,常常需要在成年前后进行阴蒂缩小术及阴道成形术。对于重度肾上腺皮质增生的患者亦可采取手术肾上腺切除。
CAH引起雄激素分泌过多,过多的雄激素导致女性患者表现为男性化,轻者阴蒂稍增大,严重者可有男性外观的外生殖器,但阴囊内无性腺;内生殖器仍为女性型。闭经或月经不规律是较为常见的表现,经治疗后多数能获得妊娠。
CAH的女性分娩率低,其原因主要包括:生殖道发育异常、同性恋比例增加。生育力降低主要由于伴发多囊卵巢综合征(肾上腺源性的雄激素过多)及雄激素过多,影响卵巢的激素周期导致无排卵。
治疗后的CAH患者,多数女孩能够发生月经。但是,如果糖皮质激素治疗不足,会引起高雄血症,从而发生无排卵功血。生育率降低,其原因为高雄激素血症引起的无排卵;并且与突变的程度相关。有生育要求的CAH患者获得治疗后,其妊娠率约为60%。
CAH患者妊娠,其女性后代若无基因突变,其生殖器没有男性化问题,但妊娠期需要对CAH患者的雄激素水平进行严格的监控。
妊娠期,应避免使用能够穿透胎盘的糖皮质激素,如地塞米松;可以使用氢化可的松或泼尼松及氟氢可的松。
11β-OHD缺乏主要是皮质醇合成减少,ACTH分泌增多,酶催化反应步骤的前体类固醇11-去氧皮质醇、11-去氧皮质酮和雄激素蓄积。其与21-OHD缺乏相同的是雄激素过多的相关症状,所不同的是,有足够的盐皮质激素作用而无失盐表现,过多的盐皮质激素作用引起高血压。
17α-OHD缺乏患者睾酮及雌二醇水平下降,FSH及LH增高。皮质醇水平低下,孕酮、孕烯醇酮及孕二醇增多。醛固酮及肾素降低。女性患者卵巢不发育,内外生殖器为幼稚女性型,到了青春期年龄无性成熟表现,第二性征缺如。多数有高血压和低血钾。少见17α-OHD不完全缺乏者,患者可有不同程度的乳房发育、外生殖器性别模糊、高血压及低血钾,其17α-羟孕酮、皮质醇和醛固酮可正常,也可以降低。
以上几种CAH其他类型的糖皮质激素的补充治疗方法与21-OHD相同。
2.原发性慢性肾上腺皮质功能减退症(Addison病)
肾上腺皮质功能减退症按病程可分为慢性和急性,按病因可分为原发性和继发性。慢性肾上腺皮质功能减退症多见于中年人;急性肾上腺皮质功能减退症多继发于Sheehan病,或是慢性肾上腺功能不全患者在应激、手术、感染、创伤等情况下诱发。原发性又称为Addison病,是由于自身免疫、结核感染等因素破坏了90%以上的肾上腺所致。其中结核性者以男性多见,自身免疫性者多见于女性。继发性是指垂体、下丘脑等病变引起ACTH不足所致,以继发于垂体疾病多见,也有继发于下丘脑CRH和其他促ACTH释放因子不足者。结核在全球得以防控后,自身免疫因素为Addison病的主要原因。
慢性肾上腺皮质功能减退症起病隐匿,病情逐渐加重,主要表现为易疲劳、乏力、体重减轻、厌食、恶心呕吐、腹痛和体位性低血压等。其最具特征的表现为皮肤黏膜色素沉着,呈棕褐色,分布全身,但在暴露及易摩擦的部位(面部、躯干部、掌纹、乳晕、甲床、足背、瘢痕和束腰带部位)更明显,齿龈、舌表面和颊黏膜也常有色素沉着,更典型皮肤改变是在弥漫性色素沉着中有白癜风。肾上腺脑白质营养不良症还可有中枢神经系统症状,而且多数患者的肾上腺皮质功能减退的症状不典型。而继发性肾上腺皮质功能减退症肤色苍白。合并其他腺垂体功能减退时可有甲状腺和性腺功能减退,表现为不耐寒、便秘、闭经、腋毛阴毛稀少、性欲减退、阳痿等;青少年患者常表现生长迟缓和青春期发育延迟。下丘脑或垂体占位病变还可有头痛、视野缺损和中枢性尿崩症。
Addison病的治疗首先是让患者了解终生替代治疗的重要性,药物包括糖皮质激素、盐皮质激素及矿物质。如为免疫因素所致,需要检查其他腺体的功能,合并其他腺体功能异常者需要做相应的治疗。如为结核所致,应积极给予抗结核治疗。
Addison病女性患者阴毛腋毛减少或脱落稀疏,月经失调或闭经。早期诊断、及时进行治疗,有望获得妊娠,但生育力是下降的,可能的原因是雄激素的减少,影响性欲及性生活,以及担心妊娠加重病情而采取避孕措施,另一些人由于合并免疫系统的异常而降低妊娠率;少部分患者因发生卵巢早衰而丧失生育能力。
Addison病的患者妊娠可加重母体负担,严重者可发生孕妇死亡;Addison病孕妇剖宫产率增加,早产的比例也增加,但良好的药物补充及病情监测可平稳度过妊娠及分娩,并获得健康新生儿。
妊娠期间孕激素产生生理性的醛固酮拮抗,需要根据血压及电解质调整盐皮质激素的用量。妊娠期应使用氢化可的松或泼尼松及氟氢可的松等不能穿透胎盘的糖皮质激素,孕晚期所需药物尽量一般会增加,应激及临产分娩/剖宫产前后需要量增加,用药根据血钾及血压调整剂量,产后迅速恢复孕前所需剂量。
综上,HPA轴与HPO轴同为女性重要的内分泌系统,两个系统的下丘脑-垂体解剖结构邻近、激素分泌反馈效应机制相似、HPA轴自身分泌雌孕激素及雄激素等性激素,某些致病因素,如免疫、炎症因素可能同时作用于这两个内分泌系统的某一或多个靶器官,HPA轴的某些病变会同时引起HPO轴的变化,表现为女性激素的改变、月经的变化及性征异常,影响妊娠分娩的结局。因此,对HPA轴与HPO轴相互关系的理解,有助于妇产科医师更好地理解和处理临床相关问题,改善女性生殖健康。


