糖皮质激素代谢酶——11β-羟基类固醇脱氢酶
2023-05-08 10:29:16 点击数:糖皮质激素代谢酶——11β-羟基类固醇脱氢酶
虽然胎盘合成孕激素和雌激素的能力很强,但由于胎盘缺乏两种细胞色素P-450酶(21β-羟化酶和11β-羟化酶),因此不能催化孕酮转化为皮质酮、皮质醇或醛固酮。胎盘也就不具备从头合成糖皮质激素和盐皮质激素的能力。但妊娠期间,母体肾上腺和胎儿肾上腺来源的糖皮质激素随孕期逐渐增多。胎盘、胎膜存在糖皮质激素受体,是糖皮质激素的重要靶器官,妊娠期糖皮质激素不仅调节胎盘激素的合成和释放,而且还可以促进胎儿器官的成熟,特别是肺、肠道和脑等器官。但胎儿过早、过多地接触糖皮质激素往往可以导致胎儿生长受限。虽然胎儿肾上腺较早具有合成雄激素供给胎盘合成雌激素的能力,但直到妊娠晚期,胎儿肾上腺才合成和分泌糖皮质激素,而妊娠期间母体血液中的糖皮质激素的浓度却随孕期不断升高。虽然血液中的大部分糖皮质激素与糖皮质激素结合蛋白(CBG)结合在一起,但母体血液中游离的糖皮质激素仍然比胎儿体内高十几倍,所以必须建立一道阻止母体糖皮质激素进入胎儿体内的胎盘屏障,以保证胎儿生长的低水平糖皮质激素环境。糖皮质激素对胎盘、胎膜作用的调节和胎盘的糖皮质激素屏障都是由糖皮质激素代谢酶——11β-羟基类固醇脱氢酶(11βhydroxysteroid dehydrogenase,11β-HSD)承担的。
体内存在两条主要的糖皮质激素代谢途径:一条是由肝脏将皮质醇转化为二氢皮质醇、四氢皮质醇或17-酮基类固醇,然后与葡萄糖醛酸或硫酸结合成脂,由尿排除;另一条途径广泛存在于体内,是由组织中的11β-HSD催化糖皮质激素与其代谢物之间的相互转化。胎盘含有大量的糖皮质激素代谢酶11β-HSD。
11β-HSD属于短链酒精脱氢酶家族成员之一,它催化糖皮质激素结构中第11位碳原子上的酮基与羟基之间的氧化还原反应,使有生物活性的皮质醇(cortisol)与无活性的17-羟-11-脱氢皮质酮(cortisone,可的松)相互转化;在啮齿类,它催化皮质酮(corticosterone)与脱氢皮质酮(dehydrocorticosterone)之间的转化(图5-4)。虽然早在20世纪50年代末,人们对11β-HSD的功能就有所认识,但直到20世纪80年代,人们才发现11β-HSD是决定盐皮质激素受体特异性和胎盘糖皮质激素屏障的关键因素,这才引起人们对此酶的重新认识和重视。近年来,随着11β-HSD同工异构酶的发现及其基因的克隆,11β-HSD在体内新的功能不断被发现,目前关于此酶的研究已经成为类固醇激素研究的一个活跃领域。
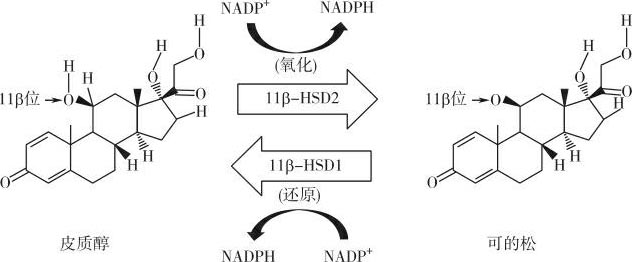
图5-4 11β-羟基类固醇脱氢酶催化的糖皮质激素的转化
(1)两型11β-HSD同工酶:
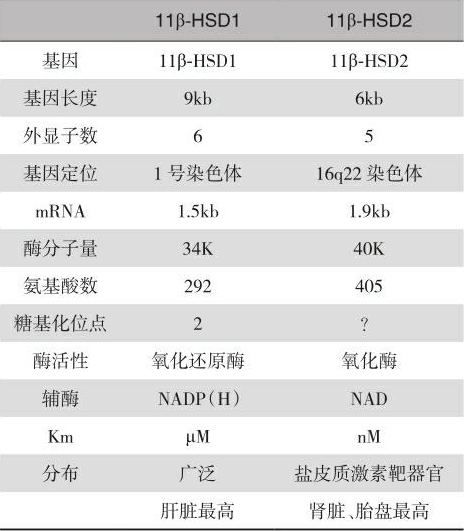
随之人们首先从大鼠肝脏分离纯化了11β-HSD,发现此酶主要以糖基化的形式存在于微粒体中,其作用依赖于辅酶NADP(H)。但它并不是单纯的氧化酶,而具有氧化还原酶的双向催化作用,既可使皮质醇脱氢氧化为无活性的17-羟-11-脱氢皮质酮,又可使无活性的17-羟-11-脱氢皮质酮还原为有活性的皮质醇,但以还原酶作用为主。肝脏11β-HSD的催化特性有悖于11β-HSD对盐皮质激素受体的保护作用。进一步的研究还发现,肝脏11β-HSD对皮质醇的米氏常数(Km)在μM水平,高于血液循环糖皮质激素的nM水平,显然也不适应此酶对盐皮质激素受体的保护作用。另外,肝脏11β-HSD及其mRNA也不存在于富含MR受体的肾脏集合小管细胞。更令人难以理解的是AME病人没有肝型11β-HSD基因的变异。以上研究结果均提示,肝型11β-HSD担任保护肾脏MR受体的可能性很小。因此,有人提出肾脏可能还存在一种高亲和力并仅具有脱氢酶单向催化作用的11β-HSD亚型。1992年,Mercer和Krozowski发现,肾脏富含MR的远曲小管和集合管存在一种依赖于辅酶NAD + 的11β-HSD氧化酶。他们把先前发现的依赖于辅酶NADP(H)的肝型11β-HSD称为一型11β-HSD(11β-HSD1),而依赖于辅酶NAD + 的肾型11β-HSD称为二型11β-HSD(11β-HSD2)。1994年,Stewart等对肾脏11β-HSD的酶动力学进行了研究,发现肾脏确实存在一种高亲和力并依赖于辅酶NAD的11β-HSD,它与皮质醇和皮质酮结合的Km值分别为60nM和13nM。1993年,Brown等人首先从人类胎盘部分纯化了11β-HSD2,此酶与已纯化的肝脏11β-HSD相比具有不同的免疫原特性,不为肝脏11β-HSD的抗体所识别,而且具有单向脱氢氧化酶的催化特性。因此人们推测,肾脏11β-HSD的催化特性可能类似胎盘11β-HSD。随后不久人们便分别克隆了羊、人类、兔、大鼠肾脏的11β-HSD2 cRNA,发现11β-HSD2和11β-HSD1是不同的基因产物,11β-HSD2只具有氧化酶的活性,对糖皮质激素的亲和力在nM范围,其mRNA和酶蛋白存在于肾脏的远曲小管和集合小管,AME病人也的确有11β-HSD2基因的变异。从而确认了体内存在两型11β-HSD,11β-HSD2是赋予盐皮质激素受体特异作用的关键因素。表5-1是两型11β-HSD的比较。
表5-1 人类11β-HSD1和2的比较
(2)11β-HSD1和11β-HSD2在胎盘和胎膜中的分布和作用:
糖皮质激素虽然可以促进胎儿肺脏和胃肠道等器官的成熟,但过多的糖皮质激素抑制胎儿的生长发育,并对脑和肾脏产生不良影响,甚至编程胎源性疾病的发生。胚胎初期,胎儿本身基本不产生糖皮质激素。胚胎后期,由于胚胎器官成熟和分娩启动的需要,胎儿肾上腺开始制造自身的糖皮质激素。接近足月时,胎儿血液循环的糖皮质激素75%来源于自身。因此,妊娠期间母体和胎儿之间需要一道屏障以阻挡高于胎儿5~10倍浓度的母体糖皮质激素进入胎儿血液循环。
虽然胎儿的一些器官在胚胎早期就有11β-HSD2的表达,可以灭活进入胎儿体内的糖皮质激素,但胎儿循环中17-羟-11-脱氢皮质酮主要来源于母体,说明糖皮质激素在通过胎盘时,多数已被转化为无活性的17-羟-11-脱氢皮质酮。胎盘11β-HSD2的屏障作用比胎儿本身组织表达的11β-HSD2更为重要。人类胎盘灌流实验则直接表明,灌流入胎盘母体侧绒毛小叶间隙的皮质醇大部分被转化为17-羟-11-脱氢皮质酮并由胎儿侧静脉流出,即糖皮质激素在进入胎儿循环前大部分被胎盘11β-HSD2转化为无活性的17-羟-11-脱氢皮质酮,胎儿组织中11β-HSD2只为避免糖皮质激素作用于胎儿提供了第二道防线。
胎盘是体内11β-HSD2含量最高的器官之一,整个妊娠过程中胎盘11β-HSD的活性都以脱氢氧化酶为主,现已在人类、狒狒、大鼠、羊、猪胎盘中发现有11β-HSD2的存在。免疫组织化学研究发现,胎盘11β-HSD2主要分布于母体血液与胎盘组织交界的胎盘绒毛膜小叶的合体滋养层细胞,使11β-HSD2处于调控母体糖皮质激素进入胎儿循环的前沿。
英国David Barker教授等的流行病学研究表明,相对胎龄低出生体重(胎儿生长受限)并伴有过大胎盘的婴儿,成年后高血压、非胰岛素依赖性糖尿病的发病率较高,此类病人往往死于缺血性心脏病。提示胎儿宫内生长发育的环境可能编程成年疾病即胎源性疾病的发生。
胎儿生长受限产生的原因一般认为与营养不良有关。近年来发现,糖皮质激素同样也为胎儿生长受限发生的重要原因,而且与疾病印迹的关系更为密切。妊娠期营养不良可导致胎盘11β-HSD2的活性降低、胎儿体内糖皮质激素浓度过高。因此,胎盘11β-HSD2的功能异常造成过多糖皮质激素进入胎儿体内可能是胎儿生长受限的重要环节。动物实验发现,大鼠胎盘11β-HSD2的活性与出生体重成正比,与胎盘重量成反比。妊娠期给予大鼠地塞米松或11β-HSD抑制剂CBX,可以导致胎鼠生长受限。此类胎鼠成年后,心血管疾病和糖尿病的发病率均高于正常鼠。人类实验也发现,生长受限胎儿的血液糖皮质激素浓度增加,妊娠期接受糖皮质激素治疗的孕妇,可以导致胎儿生长受限。另外,先天性缺乏11β-HSD2基因的AME病人,出生时也多伴有胎儿生长受限。人类胎盘11β-HSD2的活性虽然与胎盘的重量无相关性,却与出生体重呈正相关。以上动物和人类的观察均表明,胎盘11β-HSD2的功能异常是胎儿生长受限的重要原因。
过去人们普遍认为胎盘只存在11β-HSD2,其实胎盘11β-HSD还原酶的活性在妊娠早期即已存在,而且随妊娠的进展有增加的趋势。免疫组织化学研究表明,11β-HSD1与11β-HSD2的分布截然不同:11β-HSD1存在于人类胎盘的血管内皮、过渡型滋养层细胞、羊膜的上皮细胞和绒毛膜的滋养层细胞及蜕膜细胞,并以绒毛膜的含量为最高。含有11β-HSD2的合体滋养层细胞却不含有11β-HSD1。PCR和Northern分析结果支持免疫组织化学的研究结果,即胎盘、胎膜和蜕膜组织均表达11β-HSD1mRNA,但以绒毛膜的11β-HSD1 mRNA水平为最高。体外培养的绒毛膜滋养层细胞主要表现为11β-HSD1还原酶的活性,而胎盘合体滋养层细胞则主要表现11β-HSD2氧化酶的活性,这也进一步证实了免疫组织化学和mRNA的分析结果。
人类胎盘体外灌流实验发现,将17-羟-11-脱氢皮质酮灌流入胎盘母体侧绒毛小叶间隙,于胎儿侧静脉可以检测到皮质醇,说明胎盘11β-HSD1可能与11β-HSD2相辅相成精细调节糖皮质激素进入胎儿体内的量。胎膜11β-HSD1存在的意义目前尚不清楚,可能参与糖皮质激素的局部作用。实验发现,胎膜11β-HSD1通过转化17-羟-11-脱氢皮质酮为有活性的皮质醇抑制绒毛膜前列腺素降解酶的活性,从而减少前列腺素的降解。胎膜11β-HSD1产生的皮质醇还促进胎膜局部前列腺素的合成。胎膜11β-HSD1的这些作用可能与分娩启动和胎膜的破裂有关。


